Второй закон термодинамики является одним из основных законов физики, описывающим направленность процессов в термодинамических системах. Он устанавливает, что энтропия замкнутой системы всегда будет увеличиваться или оставаться постоянной, но никогда не уменьшаться.
Этот закон представляет собой фундаментальную концепцию в физике, которая имеет важное значение для объяснения различных явлений, таких как равновесие и необратимость процессов. Он помогает понять, например, почему чашка горячего кофе со временем остывает или почему бензин, сжигаемый в двигателе, превращается в тепло и движение, но нельзя обратить процесс и восстановить бензин из тепла и движения.
Основным выражением второго закона термодинамики является увеличение энтропии замкнутой системы. Энтропия, обозначаемая символом S, представляет собой меру беспорядка или неупорядоченности системы. Увеличение энтропии указывает на увеличение беспорядка в системе или расширение возможных состояний.
Закон можно сформулировать следующим образом: в естественных процессах, происходящих в изолированных системах, энтропия всегда увеличивается или остается постоянной, но никогда не уменьшается. Это означает, что система всегда стремится к более вероятному и неупорядоченному состоянию.
Общая информация о втором законе термодинамики
Энтропия — это мера хаоса в системе, показывающая, насколько возможными являются различные состояния системы. Второй закон говорит нам, что естественное движение системы происходит в сторону увеличения энтропии, то есть в сторону увеличения хаоса.
Это означает, что теплота всегда будет перетекать от горячего тела к холодному телу, а не наоборот. Это объясняет, почему не существует машин, способных работать без внесения энергии из внешних источников.
Второй закон термодинамики имеет большое значение в различных областях науки и инженерии, включая физику, химию, энергетику и технику. Знание и понимание этого закона позволяет предсказывать и оптимизировать энергетические процессы, а также разрабатывать эффективные системы и устройства.
Понятие
Второй закон термодинамики можно также сформулировать в виде понятия «определенности направления». Он утверждает, что процессы в закрытой системе происходят всегда в определенном направлении — от состояний с более высокой энтропией к состояниям с более низкой энтропией.
Основное значение второго закона термодинамики заключается в возможности определить, какой из двух процессов будет считаться «естественным» и какой — «неестественным». Например, взаимодействие горячего и холодного объектов (передача тепла от горячего объекта к холодному) является естественным процессом, так как оно увеличивает общую энтропию системы. Напротив, передача тепла от холодного к горячему объекту является неестественным процессом, так как он нарушает закон увеличения энтропии.
Примером второго закона термодинамики может служить равномерное распределение тепла в закрытом помещении. Если в одном углу комнаты установлен обогреватель, то тепло будет распространяться по всему помещению до тех пор, пока не будет достигнуто равновесие температуры. Это происходит потому, что тепло стремится к равномерному распределению, увеличивая энтропию системы.
Второй закон термодинамики играет важную роль не только в физике, но и в других областях науки, таких как химия, биология и космология. На его основе строятся различные технические устройства, в том числе двигатели внутреннего сгорания, холодильники и кондиционеры, которые используют энергию и взаимодействие веществ для работы.
Формулировка
Второй закон термодинамики устанавливает, что в изолированной системе энтропия всегда увеличивается или остается постоянной, но никогда не уменьшается. Это означает, что процессы, происходящие в природе, всегда направлены к равновесию.
На микроскопическом уровне второй закон термодинамики утверждает, что в системе, состоящей из независимых частиц, вероятность нахождения системы в состоянии с низкой энергией больше, чем в состоянии с высокой энергией.
Если взять во внимание вселенную, применительно ко всем процессам и временам, то второй закон термодинамики утверждает, что энтропия системы всегда будет увеличиваться со временем, что в конечном итоге приведет к тепловой смерти вселенной.
Примеры применения второго закона термодинамики
1. Тепловые двигатели: Второй закон термодинамики объясняет, почему эффективность тепловых двигателей ограничена. В соответствии с законом, невозможно полностью преобразовать тепловую энергию в механическую работу. Это означает, что всегда будет некоторая потеря энергии в виде тепла, что ограничивает максимальную эффективность двигателя.
2. Холодильники и кондиционеры: Второй закон термодинамики объясняет, как работают холодильники и кондиционеры. Они позволяют перенести тепло из холодной области в горячую, что требует энергии. Второй закон термодинамики гарантирует, что энергия будет расходоваться в процессе переноса тепла, создавая разность температур и поддерживая холодную область.
3. Энтропия и беспорядок: Второй закон термодинамики связан с понятием энтропии, которая описывает степень беспорядка в системе. Второй закон гласит, что энтропия изолированной системы будет всегда увеличиваться или оставаться постоянной со временем. Это объясняет, почему природные процессы идут в сторону увеличения беспорядка.
Эти примеры демонстрируют практическое применение второго закона термодинамики в различных областях физики и инженерии. Знание и понимание этого закона позволяет разрабатывать эффективные тепловые системы, прогнозировать и анализировать процессы и явления, связанные с теплом и энергией.
Пример 1
Рассмотрим пример, чтобы лучше понять второй закон термодинамики.
Представим ситуацию, когда у нас есть две комнаты: комната А и комната В. Комната А имеет высокую температуру, а комната В — низкую температуру.
Мы открываем дверь между комнатами, и тепло начинает переходить из комнаты А в комнату В. Этот процесс непрерывно продолжается, пока температура в обеих комнатах не выровняется. В результате энергия тепла, которая изначально была в комнате А, распределяется равномерно между двумя комнатами.
Это пример нарушения второго закона термодинамики. Второй закон термодинамики утверждает, что энергия всегда будет переходить от областей с более высокой температурой к областям с более низкой температурой, пока не наступит равновесие. То есть, тепло не будет переходить самопроизвольно из холодного объекта в горячий объект.
Это пример простого объяснения второго закона термодинамики и его применения в реальной жизни.
| Комната | Температура |
|---|---|
| A | Высокая |
| В | Низкая |
Пример 2
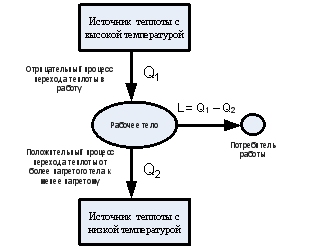
Рассмотрим закрытую систему, состоящую из трех частей: двигателя, нагревателя и холодильника. В двигателе происходит процесс сгорания топлива, в результате которого происходит выделение тепла, часть которого используется для производства полезной работы, а оставшаяся часть отдается окружающей среде в виде тепла. После этого работающая среда двигателя попадает в нагреватель, где ей подводится дополнительное количество тепла, после чего она попадает в холодильник, где происходит отвод избыточного тепла в окружающую среду.
В этом примере происходит перераспределение тепла в системе: изначально тепло выделяется в двигателе, затем оно переносится в нагреватель, а затем в холодильник. По второму закону термодинамики, эффективность такой системы всегда будет меньше 1. Это связано с тем, что при каждом переносе тепла часть его потеряется в окружающей среде и не будет использована для производства работы.
Вопрос-ответ:
Что такое второй закон термодинамики?
Второй закон термодинамики — это одно из основных положений физики, устанавливающее, что в изолированной системе энтропия всегда увеличивается или остается неизменной со временем.
Каким образом можно объяснить второй закон термодинамики?
Второй закон термодинамики можно объяснить следующим образом: энтропия — это мера беспорядка или неупорядоченности частиц в системе. В изолированной системе беспорядок будет естественно возрастать со временем. Таким образом, второй закон термодинамики описывает направление возможного изменения системы: от упорядоченности к беспорядку.
Какие примеры можно привести в подтверждение второго закона термодинамики?
Существует множество примеров, подтверждающих второй закон термодинамики. Например, рассмотрим ситуацию с теплопроводностью. Если у вас есть металлическая пластина с горячей и холодной сторонами, тепло будет передаваться от горячей стороны к холодной, пока температура не выровняется. Это объясняется тем, что энтропия системы увеличивается в результате перемещения тепла от горячего к холодному объекту. Еще один пример — это спонтанное смешивание газов. Если у вас есть два газа с разными концентрациями в двух отдельных отсеках, по истечении времени газы равномерно смешаются, что также связано с увеличением энтропии системы.