Периодический закон Д. И. Менделеева представляет собой одну из основных основ современной химии. Этот закон варьирует основные принципы организации и классификации химических элементов, позволяя химикам лучше понимать и изучать свойства и структуру материи.
Формулировка периодического закона утверждает, что свойства химических элементов регулярно повторяются при их систематическом расположении по порядку возрастания атомного номера. Внутри таблицы Менделеева элементы упорядочены в группы и периоды в соответствии с их электронной конфигурацией и химическими свойствами.
Периодический закон Менделеева оказал огромное влияние на развитие химии, особенно в области химической технологии, материаловедения и электрохимии. С его помощью было возможно установить закономерности в свойствах химических элементов и предсказать свойства еще неизвестных элементов, что привело к открытию новых элементов и развитию новых технологий.
Формулировка периодического закона
- Свойства химических элементов периодически изменяются в зависимости от их атомных номеров.
- При расположении элементов по возрастанию атомных номеров вертикально и горизонтально в таблице, можно наблюдать периодическое повторение их физических и химических свойств.
Происходит периодическое изменение свойств элементов, таких как радиус атома, электроотрицательность, ионизационная энергия и т.д. Это обусловлено изменением строения и расположения электронных оболочек в атомах элементов.
Периодический закон предоставляет основу для систематического классификации химических элементов и позволяет предсказывать и объяснять их свойства на основе их положения в периодической системе.
Периодическое повторение свойств элементов
Периодическую закономерность свойств элементов можно объяснить их электронной структурой. Внешний слой электронов в атоме, или валентная оболочка, имеет ключевое значение для определения химических свойств элементов. Ученые отметили, что при полном заполнении и половинном заполнении s-, p- и d-орбиталей электронов происходит стабилизация атома и его химические свойства меняются. Это повторение закономерностей отражается в периодической системе элементов.
Периодическое повторение свойств элементов проявляется в различных физических и химических параметрах, таких как радиус атома, электроотрицательность, ионизационная энергия, атомный радиус и т.д. Например, в периоде атомный радиус уменьшается слева направо, так как количество протонов в атомном ядре увеличивается. А в группе атомный радиус увеличивается сверху вниз, так как увеличивается количество энергетических уровней.
- Электроотрицательность элементов также периодически повторяется. Электроотрицательность показывает способность атомов привлекать электроны к себе. Атомы с большей электроотрицательностью имеют большую силу притяжения к электронам и образуют ионы с отрицательным зарядом. Наиболее электроотрицательными элементами являются флуор, хлор, кислород, атомы щелочных и щелочноземельных металлов имеют наименьшую электроотрицательность.
- Ионизационная энергия — энергия, необходимая для удаления одного электрона из атома. Она также периодически повторяется и зависит от атомного радиуса и количества слоев электронов. Атомы с малым атомным радиусом и максимальным количеством слоев электронов имеют наибольшую ионизационную энергию. Это связано с сильной силой притяжения электронов к ядру.
- Другие характеристики, такие как точка плавления и кипения, также могут периодически изменяться в периодической системе элементов. Например, металлы имеют обычно более высокие точки плавления и кипения, чем неметаллы.
Понимание периодического повторения свойств элементов позволяет ученым анализировать и предсказывать химические реакции и взаимодействия элементов, а также создавать новые соединения и материалы с нужными свойствами.
Расположение элементов по атомному номеру
Таблица Менделеева, представленная в виде периодической системы элементов, упорядочена по атомному номеру. Элементы располагаются в строгом порядке, начиная с самого легкого элемента с наименьшим атомным номером и заканчивая самым тяжелым элементом с наибольшим атомным номером.
Расположение элементов по атомному номеру позволяет выделить определенные закономерности и связи между элементами. При движении по периоду – строке таблицы – атомный номер элементов возрастает, а их свойства изменяются. При движении по группе – столбцу таблицы – атомный номер остается постоянным, но происходит изменение электронной конфигурации и химических свойств элементов.
Расположение элементов по атомному номеру позволяет проводить систематическое изучение химических свойств и закономерностей периодической системы элементов. Оно является базовым принципом периодического закона Д. И. Менделеева и дает основу для предсказания свойств новых элементов, открытия новых закономерностей и разработки новых химических соединений.
Основные принципы периодического закона
Основные принципы периодического закона включают:
- Периодическая таблица элементов: основная удобная форма представления периодического закона. В ней элементы располагаются в порядке их атомного номера, группируются по сходству свойств.
- Периоды и группы: периоды – это горизонтальные строки элементов в таблице, группы – это вертикальные столбцы, элементы которых имеют схожие свойства. Периоды и группы помогают систематизировать элементы и предсказывать их химическое поведение.
- Периодические свойства: элементы одной группы имеют схожие химические свойства, такие как валентность, химический радиус, электроотрицательность, атомный объем и т.д.
- Тренды: периодический закон позволяет определить закономерности изменения свойств элементов внутри периодов и групп. Например, электроотрицательность элементов возрастает со снижением группы и увеличением периода.
- Важность для химической науки и применений: периодический закон является фундаментальным принципом, на котором строятся основные законы и теории химии. Он также позволяет предсказывать свойства новых элементов и создавать различные химические соединения.
Основные принципы периодического закона Менделеева оказались важными для развития химии и помогли создать общей представление об устройстве химического мира. Знание и понимание этих принципов являются необходимыми для изучения химии и развития новых материалов и технологий.
Расположение элементов в таблице
Периодическая таблица химических элементов представляет собой удобное и систематизированное графическое представление всех известных на данный момент химических элементов. Открытый в 1869 году русским химиком Д. И. Менделеевым, периодический закон был сформулирован на основе наблюдаемых химических свойств и химического состава элементов.
В периодической таблице элементы располагаются в порядке возрастания атомного номера (количества протонов в ядре атома) в горизонтальных строках, называемых периодами. Каждый новый период начинается с элемента, у которого атомный номер увеличивается на единицу по сравнению с предыдущим. Таким образом, горизонтальное расположение элементов в таблице указывает на изменение количества электронных оболочек в атомах.
Вертикальные столбцы в таблице называются группами. В пределах одной группы элементы обладают схожими химическими свойствами, так как имеют одинаковое число электронов на внешней энергетической оболочке (валентные электроны). Главный элемент каждой группы называется представителем группы, а номер группы указывает на количество валентных электронов атомов.
Периодическая таблица также содержит блоки элементов, которые выделяются цветом или располагаются в отдельной части таблицы. Эти блоки включают переходные металлы, инертные газы и лантаноиды/актиноиды. Они имеют отличные от основных групп химические свойства и обладают специфическими электронными конфигурациями.
Таким образом, расположение элементов в периодической таблице основывается на их атомных номерах, химических свойствах и электронной структуре. Это графическое представление помогает исследователям и ученым организовать и классифицировать химические элементы, а также предсказывать их свойства и взаимодействия.
Возрастание атомного номера от верхнего левого до нижнего правого угла
Периодическая система химических элементов, разработанная Дмитрием Ивановичем Менделеевым, организует элементы в порядке возрастания атомного номера от верхнего левого до нижнего правого угла.
Атомный номер характеризует количество протонов в атоме элемента, и его увеличение отражает постепенное добавление протонов к ядру атома. Периодическая система представляет собой удобную таблицу, где элементы разделены на строки (периоды) и столбцы (группы), отражающие химические свойства элементов.
По мере движения слева направо по периоду, атомные номера элементов увеличиваются. Это связано с добавлением одного протона к ядру в каждом последующем элементе. Например, в первом периоде первый элемент, водород, имеет атомный номер 1, а второй элемент, гелий, имеет атомный номер 2. Атомный номер увеличивается на 1 для каждого элемента в периоде.
Когда период заканчивается, новый период начинается ниже предыдущего. Атомный номер продолжает возрастать от верхнего левого угла до нижнего правого угла, пока не будет достигнут последний элемент в правом нижнем углу — оганессон с атомным номером 118.
Таким образом, возрастание атомного номера от верхнего левого до нижнего правого угла в периодической системе отражает систематическую организацию элементов на основе их атомных свойств и является одной из основных принципов периодического закона Д. И. Менделеева.
Группировка элементов с похожими свойствами
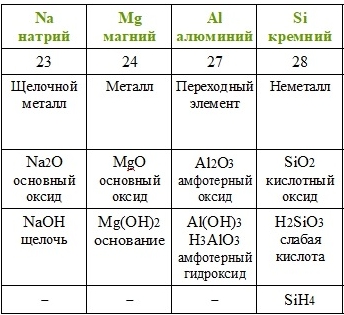
Всего в таблице Менделеева есть 18 вертикальных колонок, которые называются группами. Каждая группа имеет свой номер и букву. Например, первая группа, также известная как щелочные металлы, имеет номер 1 и обозначается буквой «А». Вторая группа, называющаяся щелочноземельные металлы, имеет номер 2 и обозначается также буквой «А». Третья группа, обозначаемая буквами «В» и «AB», включает элементы с похожими свойствами, такими как алюминий и галлий.
Группы в таблице Менделеева демонстрируют периодичность свойств элементов. Элементы в одной и той же группе имеют схожую электронную конфигурацию и, следовательно, обладают схожими химическими свойствами. Например, все элементы первой группы обладают одним валентным электроном, что делает их реактивными металлами.
Группировка элементов с похожими свойствами позволяет химикам легко предсказывать химическое поведение не только известных элементов, но и появление новых элементов и их соединений.
Вопрос-ответ:
Какая формулировка периодического закона Д. И. Менделеева?
Периодический закон Д. И. Менделеева гласит, что свойства химических элементов периодически изменяются с увеличением их атомных чисел.
Какой вклад Д. И. Менделеев внес в разработку периодического закона?
Д. И. Менделеев внес огромный вклад в разработку периодического закона. Он разработал таблицу элементов, в которой элементы были упорядочены по возрастанию их атомных чисел и схожести химических свойств. Менделеев оставил пустые места в таблице для элементов, которые еще не были открыты, и предсказал их свойства на основе закономерностей, которые он обнаружил в таблице.
Какие свойства элементов изменяются периодически?
Свойства элементов, которые изменяются периодически, включают атомные радиусы, ионные радиусы, электроотрицательность, энергия ионизации, электроаффинность, металлические свойства и многое другое.
Почему периодический закон Д. И. Менделеева считается одним из самых важных достижений в области химии?
Периодический закон Д. И. Менделеева является одним из самых важных достижений в области химии, потому что он позволяет организовать и систематизировать знания о химических элементах и их свойствах. Закон позволяет предсказывать свойства новых элементов, упрощает химические расчеты и способствует развитию химической науки и технологии.
Какую формулировку имеет периодический закон Д. И Менделеева?
Периодический закон Д. И Менделеева формулируется следующим образом: «Свойства элементов периодически зависят от их атомных масс». Это означает, что если расположить элементы в таблице в порядке возрастания атомных масс, то подобные свойства будут повторяться через каждые 8 элементов.