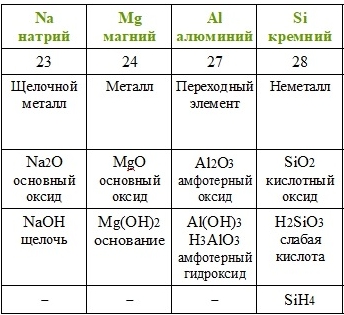
Периодический закон, также известный как закон Менделеева-Мейерса, является одним из фундаментальных принципов химии. Он устанавливает основные правила поведения элементов и их соединений в периодической системе элементов (ПСЭ) и предсказывает изменение их химических и физических свойств с изменением их атомных номеров.
Согласно периодическому закону, элементы располагаются в ПСЭ в порядке увеличения атомных номеров и группируются в периоды и группы в зависимости от их химических свойств и строения электронной оболочки. Этот закон открыл возможность обнаружения закономерностей в поведении элементов и составление систематической классификации известных и неизвестных элементов.
Одним из ключевых аспектов периодического закона является его способность предсказывать свойства элементов, которые до этого не были открыты, и обнаруживать пробелы в ПСЭ, что мотивировало исследователей на поиск новых элементов. Действительно, важным этапом в развитии периодического закона было предсказание и открытие нескольких элементов на основе пустых мест в ПСЭ. Это привело к дополнению ПСЭ и расширению наших знаний о взаимодействии и свойствах элементов с каждым новым открытием.
Принципы формулировки периодического закона
1. Закономерность повторения свойств элементов
Основополагающим принципом периодического закона является идея о том, что свойства элементов периодически повторяются в порядке возрастания атомного номера. Такое поведение наблюдается для ряда физических и химических характеристик, таких как радиусы атомов, ионные радиусы, электроотрицательность и т.д.
2. Организация элементов в таблице Менделеева
Другим важным принципом является организация элементов в таблице Менделеева. Это систематическое представление, в котором элементы расположены в порядке возрастания атомного номера, а по вертикали группируются в столбцы и называются группами, имеющими схожие свойства. Эта организация обеспечивает очень удобный способ классификации элементов и обнаружения закономерностей.
3. Периоды и блоки элементов
Периодическая система позволяет выделить горизонтальные ряды элементов, называемые периодами, и вертикальные столбцы, называемые блоками. Каждый период отображает новую электронную оболочку, а блоки представляют собой группы элементов с общими способностями к оформлению химических связей.
4. Группировка элементов по свойствам
Одной из важных особенностей периодической системы является связь между позицией элемента в группе и его химическими свойствами. Элементы одной группы имеют аналогичную реакционность и образуют схожие типы химических соединений. Это облегчает предсказание свойств и способствует систематическому изучению элементов.
5. Прогнозирование свойств неизвестных элементов
Периодический закон позволяет использовать уже известные свойства элементов для прогнозирования характеристик неизвестных. Это находит широкое применение в химической и материаловедении, а также в разработке новых соединений и материалов. Благодаря этому принципу возможно нахождение новых элементов и предсказание их свойств.
Периодический закон является фундаментальной основой химии и играет важную роль в науке и промышленности. Принципы формулировки периодического закона помогают классифицировать и изучать элементы, а также прогнозировать их свойства.
Обучение и открытие
Ученые великих мировых наук, таких как Дмитрий Менделеев и его предшественники, многие годы проводили исследования для определения свойств химических элементов и принципов, которые связывают их между собой. Этот процесс требовал больших усилий, включая экспериментальные исследования, наблюдения и статистический анализ данных.
Обучение играло важную роль в развитии химии и понимании периодического закона. Школы и университеты предоставляют платформу для изучения химии и других естественных наук, где студенты учатся основам химии, свойствам элементов, атомной структуре и другим ключевым аспектам.
Кроме того, исследователям доступны различные лаборатории и научные институты, где они могут осуществлять исследования и эксперименты по изучению элементов и их свойств. Такие учебные заведения и научные организации предоставляют возможность для обучения и открытия новых фактов и закономерностей в химии и других областях науки.
Обучение и открытие тесно связаны друг с другом, поскольку именно открытие новых знаний и фактов стимулирует учебный процесс, а обучение дает возможность дальнейших исследований и открытий. Вместе они способствуют развитию науки и расширению нашего понимания о мире.
Экспериментальное исследование
Для разработки и формулировки периодического закона химических элементов проводились многочисленные эксперименты. С помощью этих экспериментов были установлены основные принципы и ключевые аспекты периодической системы элементов.
Ученые проводили исследования, изучая химические свойства элементов и их соединений. Они анализировали реакции элементов с различными веществами, а также исследовали электропроводность, плотность, температуру плавления и кипения, массу и другие физические свойства элементов.
В результате экспериментов было установлено, что свойства химических элементов имеют периодическую зависимость от их атомных номеров. Благодаря этим исследованиям было открыто, что элементы, имеющие схожие свойства, располагаются в одной группе периодической системы.
Количественная оценка
Основными принципами периодического закона являются: наличие периодического повторения химических и физических свойств элементов при движении по периодам и группам, упорядоченность элементов в порядке возрастания атомных номеров и их расположение в таблице Менделеева.
Для количественной оценки периодического закона используются такие понятия, как атомный радиус, ионизационная энергия, электроотрицательность и другие.
Атомный радиус представляет собой половину расстояния между центрами ядер двух соседних атомов в молекуле. Он определяет размер атома и обычно измеряется в пикометрах (1 пикометр = 10-12 метра).
Ионизационная энергия – это энергия, необходимая для удаления одного электрона из атома. Она измеряется в электрон-вольтах (эВ) или килоджоулях на моль (кДж/моль).
Электроотрицательность – это мера способности атома притягивать электроны к себе в химической связи. Она определяется по шкале Полинга или по шкале Мюллекена-Полинга.
Количественная оценка периодического закона позволяет сравнивать элементы между собой, предсказывать их свойства и определять закономерности в их химическом поведении.
Ключевые аспекты формулировки периодического закона
1. Периодическая таблица – основная графическая модель, на которой отражены все элементы химических веществ. В периодической таблице элементы расположены по порядку возрастания атомного номера, а также сгруппированы по своим характеристикам и свойствам.
2. Периоды и группы – периодическая таблица разделена на горизонтальные строки, называемые периодами, и вертикальные столбцы, называемые группами. Периоды обозначают уровень электронной оболочки атома, а группы – число валентных электронов и схожие химические свойства элементов.
3. Атомный радиус – одна из важных характеристик элемента, которая определяет размер атома. С увеличением атомного номера радиус элемента обычно увеличивается, однако существуют исключения из-за активации электронных подуровней.
4. Электроотрицательность – свойство атома притягивать электроны при образовании химических связей. Оно также изменяется по периодам и группам в соответствии с формулировкой периодического закона.
5. Химическая активность – способность элемента участвовать в химических реакциях. Она определяется электронной структурой атома и зависит от положения элемента в периодической таблице.
Разработка и установление периодического закона вела к появлению новых представлений о строении атомов и их свойствах. Периодический закон стал основой для объяснения множества химических явлений и обеспечил основу для дальнейшего развития химии как науки.
Массовое число
Массовое число определяет массу атома, так как нейтроны и протоны имеют почти одинаковую массу, приближенно равную единичной массе атома. Кроме того, массовое число определяет способ обозначения изотопов, атомов одного элемента с разным числом нейтронов.
Чтобы найти количество нейтронов в атоме, можно вычесть из массового числа количество протонов, которое обозначается атомным номером и обозначается символом Z. Таким образом, число нейтронов равно A — Z.
Массовое число можно найти в проточной таблице элементов, где оно указано под именем каждого элемента или изотопа. Изотопы, у которых разное массовое число, но одинаковый атомный номер, обычно имеют разные физические свойства.
Атомное число
Атомное число обозначается символом Z и является целым числом. Число протонов в атомном ядре также определяет количество электронов в атоме, при условии, что он электрически нейтрален.
Значение атомного числа позволяет определить положение элемента в периодической таблице Менделеева. Чем больше атомное число, тем выше находится элемент в таблице. Соответственно, все элементы с одинаковым атомным числом принадлежат к одной и той же группе.
Атомное число также влияет на химические свойства элементов. Оно определяет распределение электронов в атоме и, следовательно, их возможность вступать в химические реакции. Для разных элементов с разными атомными числами, соответственно, будут характерны разные химические свойства и способность образования соединений.
| Элемент | Атомное число (Z) |
|---|---|
| Водород | 1 |
| Гелий | 2 |
| Углерод | 6 |
| Кислород | 8 |
| Железо | 26 |
Примеры элементов и их атомных чисел представлены в таблице выше. Как видно из таблицы, атомное число Углерода равно 6, что означает присутствие шести протонов в его атомном ядре.
Вопрос-ответ:
Как формулируется периодический закон?
Периодический закон формулируется как закономерность, согласно которой свойства химических элементов периодически меняются с возрастанием их атомных номеров.
Какие принципы лежат в основе формулировки периодического закона?
Основными принципами формулировки периодического закона являются возрастание атомного номера элементов и соответствующее изменение их химических свойств, а также повторение определенных свойств по мере прохождения элементов через периоды.
Какие ключевые аспекты следует учитывать при изучении периодического закона?
При изучении периодического закона необходимо учитывать такие ключевые аспекты, как расположение элементов по периодам и группам в таблице химических элементов, изменение электронной конфигурации и внешней оболочки атомов с возрастанием атомного номера, а также изменение химических свойств элементов в периодической системе.
Какие последствия имеет периодический закон для химии?
Периодический закон имеет ряд важных последствий для химии. Он позволяет классифицировать и систематизировать химические элементы, предсказывать их свойства на основе их расположения в таблице химических элементов, облегчает понимание реакций и взаимодействий элементов, а также служит основой для разработки новых материалов и соединений.
Какое значение имеет периодический закон для науки и технологий?
Периодический закон имеет огромное значение для науки и технологий. Он помогает ученым понять и объяснить химические свойства элементов, проводить исследования и эксперименты, разрабатывать новые материалы и соединения, а также применять их в различных областях, таких как фармацевтика, энергетика, электроника и другие.